期刊介绍
期刊导读
- 07/14深度丨新冠病毒解药何来?一场中国医药界的隐形
- 07/13医药界一条例被废止了
- 07/13为壮大抗日队伍,他带领上海医药界人士奔向抗
- 07/13医药界驰援武汉!罗氏捐430万元吉利德承诺提供
- 07/09国内医药界最牛夫妻档再登胡润百富榜,医药行
医药界一条例被废止了
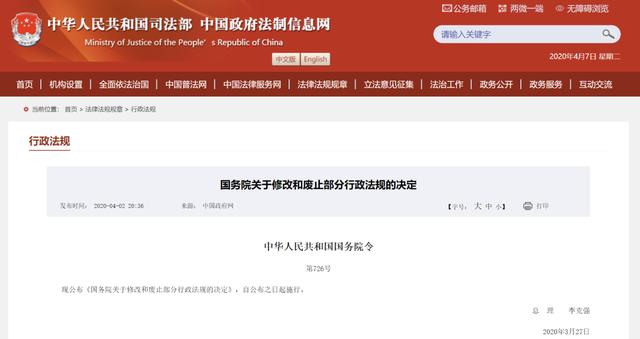
国务院发文,正式废止涉外药品行政保护。
涉外药品行政保护,废止了!
4月2日,国务院发布《关于修改和废止部分行政法规的决定》,宣布废止《药品行政保护条例》(以下简称《保护条例》),依法推进简政放权、放管结合、优化服务改革。
这意味着,这部于1992年12月12日经国务院批准,1992年12月19日由国家医药管理局发布,对外国药品独占权人的合法权益给予行政保护而制定的条例,正式退出历史舞台。
7年6个月的保护期
根据《保护条例》,未经药品独占权人许可,在七年零六个月的保护期内,既不允许批准国产,也不允许批准其他的进口或者销售,否则面临经济赔偿、法律诉讼。
之所以保护"外国药品独占权人的合法权益",《保护条例》第一条已阐明,"为了扩大对外经济技术合作与交流"。
虽然字面上很简单,但是其背后是履行《中美政府关于保护知识产权的谅解备忘录》中,"对符合条件的美国专利药品和农业化学物质产品,可以到中国申请行政保护"的承诺。
《保护条例》明确,申请行政保护的药品应当具备:1993年1月1日前依照中国专利法的规定其独占权不受保护的;1986年1月1日至1993年1月1月期间,获得禁止他人在申请人所在国制造、使用或者销售的独占权的;提出行政保护申请日前尚未在中国销售的。
那么,《保护条例》予以保护的药品,仅限于美国吗?答案很显然,非也。
根据《保护条例》,"凡与中华人民共和国缔结有关药品行政保护双边条约或者协定的国家、地区的企业和其他组织以及个人,都可以依照本条例申请药品行政保护。"
资料显示,继美国之后,中国和欧盟、日本、瑞士、瑞典、挪威等国家或地区签署了关于药品和农业化学物质产品行政保护的双边协议,也就是说,这些国家或地区的专利药品纳入了我国涉外药品保护的范畴。
涉外药品行政保护的淡出
然而,《保护条例》并非一切均如制定者所愿。很多企业借此来延长药品生产的独占权,以阻止其他企业仿制专利到期的药品,这有违"扩大对外经济技术合作与交流"的初衷。
为了打破这一困境,相关部门在条例规章上作了相应的调整。比如2002年9月15日起实施的《药品管理法实施条例》就做了相应改动:
其一是将新药由"首次在中国境内生产的药品",重新定义为"未曾在中国境内上市销售的药品";
其二是根据保护公众健康的要求,可以对药品生产企业生产的新药品种设立不超过5年的监测期;在监测期内,不得批准其他企业生产和进口。
其后出台的多部法律、法规,对新药保护有了新的规定,涉外药品行政保护进一步淡出。更为直接的表现,在于2013年12月31日,国家药监总局在其官网上发布的《美国礼来公司的盐酸度洛西汀(Duloxetine hydrochloride)终止药品行政保护(第157号)》之后,就停止了行政保护公告的更新,并取消了该专栏。
在业界看来,虽然当时国家药监总局并未明确取消行政保护,但是这是已是在用行动默认涉外药品行政保护的条例正在退出历史舞台。
鼓励创新面向国际
对于本次《保护条例》的废止,医药界显得颇为平静,毕竟这一切已是"顺理成章"的事。
事实上,2019年国家卫健委印发《第一批鼓励仿制药品目录》,列出33个鼓励仿制药品种目录,以期提质降价。当然了,国家的目标绝非仅在仿制药,而是能够走向国际的创新。
比如今年3月30日,国家市监总局公布的《药品注册管理办法》明确,国家药监局建立药品加快上市注册制度,支持以临床价值为导向的药物创新。对符合条件的药品注册申请,申请人可以申请适用突破性治疗药物、附条件批准、优先审评审批及特别审批程序。
再有就是2017年我国药监局正式成为国际人用药品注册技术要求协调会(ICH)成员,不仅意味着我国药品评审标准向国际标准靠拢,也意味着中国药企走向国际有了方便之门,那就是药品临床数据互认。
加上两票制、一致性评价、国家集采等多重政策的影响下,医药行业整体盈利下滑,进一步倒逼创新。种种动作表明,国家的大战略是从仿制驱动到创新驱动,这是一个走向国际的路线。说白了,创新拥有更大的未来。
业内人士认为,企业创新需要巨额投入,在整体盈利下滑的情况下,节约成本是关键,使用全国通用的001医药电子资料管理平台进行首营资料、检验报告等资料的管理和交换,就能够有效节省成本,提高业务效率。
文章来源:《医药界》 网址: http://www.yyjzz.cn/zonghexinwen/2020/0713/353.html